Determinación de la fórmula empírica y molecular de la glucosa
3 comments
Ahora bien, a partir de la composición del compuesto se puede determinar su fórmula empírica y molecular. Es aquí donde nos centraremos en el presente post, presentando un ejemplo práctico de este tipo de cálculos.
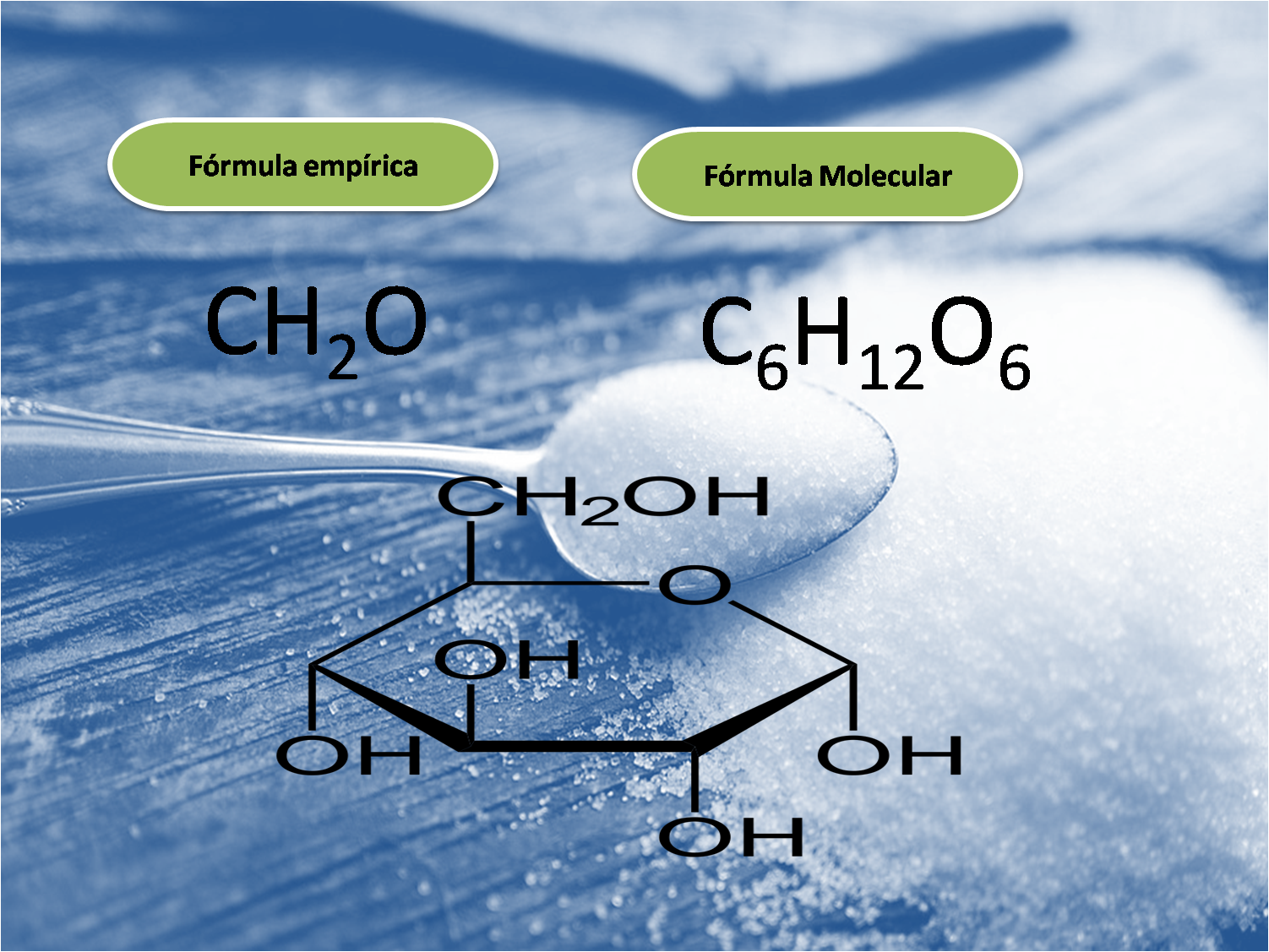
Imagen realizda en power point con imágenes de dominio público:1;2
Comencemos por diferenciar fórmula empírica y fórmula molecular. La fórmula empírica es conocida también como fórmula simplificada, ya que representa la relación más pequeña en números enteros de los átomos presentes en el compuesto, y la fórmula molecular o fórmula verdadera es la que representa el número real de átomos presentes.
Es importante destacar que a partir de la fórmula empírica y conociendo la masa molar del compuesto se puede determinar la fórmula molecular, ya que con únicamente con la formula empírica no se puede determinar la fórmula del compuesto. Existen algunos compuestos que poseen la misma fórmula empírica, por ejemplo el ácido acético y la glucosa pero con diferente fórmula molecular.
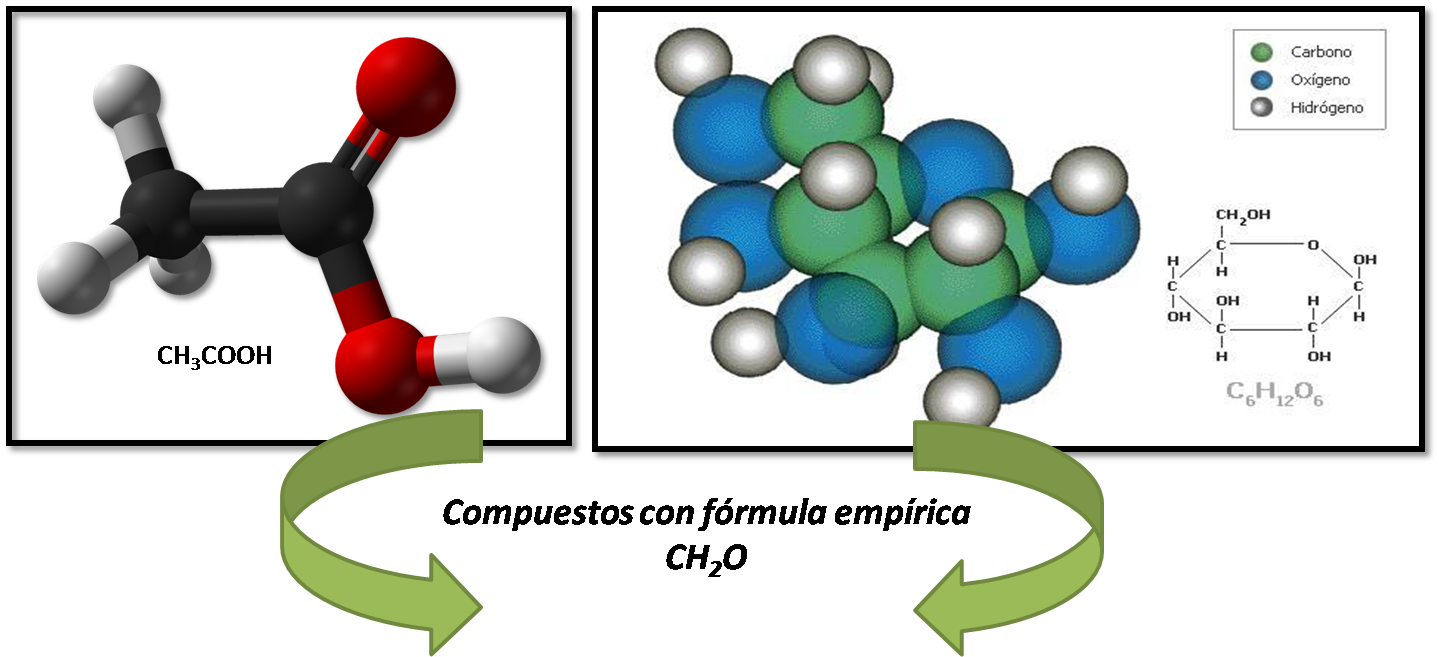
Imagen realizada en power point con imágenes de dominio público:_1<2
Muchos compuestos contienen carbono, hidrógeno y oxígeno por lo que son analizados empleando un tren de combustión como se muestra.
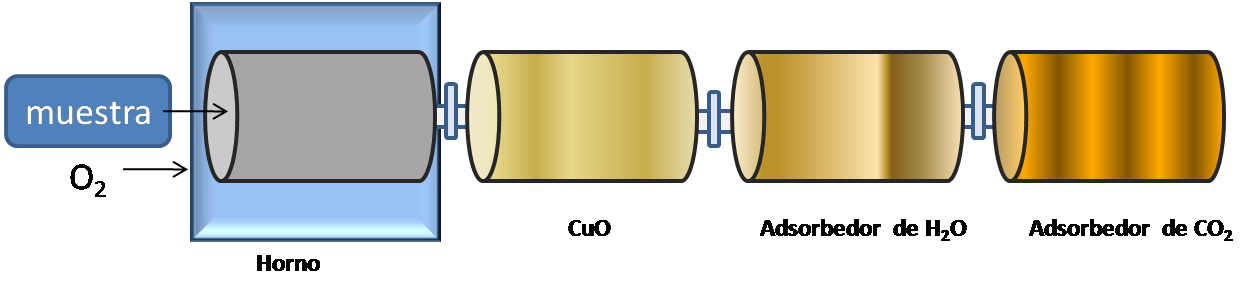
Fuente: @yusvelasquez
El sistema consiste en un horno, un adsorbente de perclorato de magnesio y un adsorbente de hidróxido de sodio. El procedimiento consiste en pesar una cantidad de muestra muy cuidadosamente y hacerla pasar por el horno donde se quema haciendo pasar una corriente de oxígeno, llevando a cabo una reacción de combustión. En esta reacción, el óxido de cobre (II) sirve para oxidar las trazas de carbón y de monóxido de carbono a dióxido de carbono y el hidrógeno en agua.
El aumento de peso en los adsorbentes del perclorato de magnesio para recolectar el H2O y el adsorbente de hidróxido de sodio para recolectar el CO2 se relaciona con los pesos y los porcentajes de carbono e hidrógeno presente en la muestra.
Una vez conocida la composición empleando este método se puede determinar la fórmula empírica del compuesto.
Veamos el siguiente ejemplo práctico para la determinación de la fórmula empírica y molecular de la glucosa
Determinación de la fórmula empírica y molecular de un compuesto sometido a combustión, obteniéndose 0.2972 g de CO2 y 0.1218 g de H2O en el análisis de 0.2028 g de muestra.
Para la determinación de la fórmula empírica y molecular se pueden seguir los pasos que se muestran a continuación.
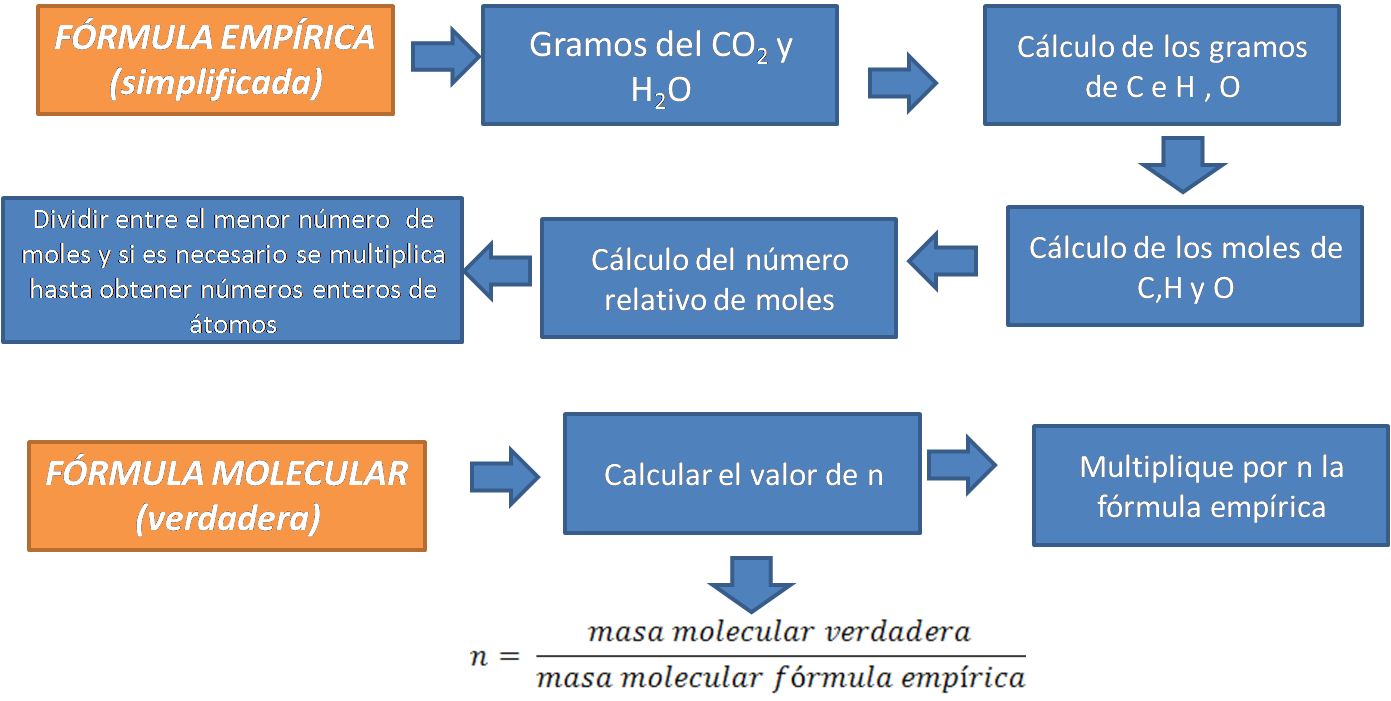
Fuente: @yusvelasquez
Comencemos con la determinación de la fórmula empírica
Cálculo de los gramos de carbono, hidrógeno y oxígeno presente en la muestra a partir de los gramos de dióxido de carbono y agua obtenidos en la combustión.
Estos cálculos se basan en conversiones empleando la masa molar y la relación molar.
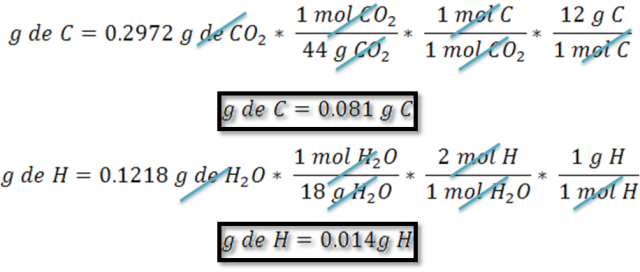
Con los resultados obtenidos en la caracterización del compuesto se puede establecer que sólo contiene carbono, hidrógeno y oxígeno, por lo que los gramos de oxígeno se pueden calcular por diferencia de peso como sigue:
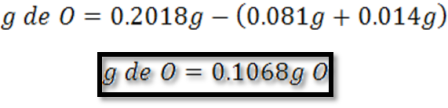
Cálculo del número de moles de cada elemento presente en el compuesto.
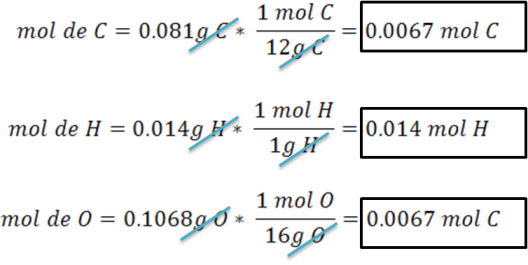
Cálculo del número relativo de moles de cada elemento.
Este cálculo se realiza dividiendo los moles de cada elemento entre el menor número de moles.
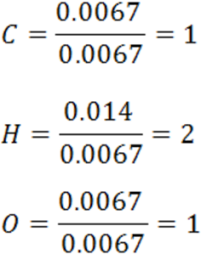
Por tanto, la relación entre C: H: O es 1:2:1
La fórmula empírica es

Determinación de la fórmula molecular
- Se determina el valor de n conociendo la masa molecular del compuesto.

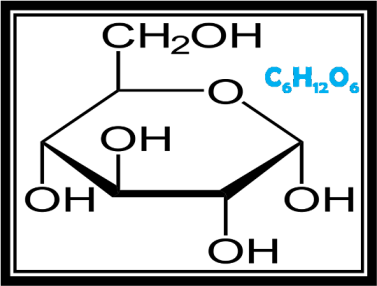
Imagen editada en power point: wikimedia.org
La determinación de la fórmula de un compuesto es esencial en química, permite estudiar su estructura, la distribución de sus átomos, por lo que es importante conocer los métodos y cálculos asociados que permitirán conocer la relación de los átomos que lo conforman.
¡Espero les sea muy útil la información presentada, gracias por leer!
Referencias
- Brown, T. (1997). Química La Ciencia Central. 7ma Edición, Prentice Hall, México.
- Whitten K. y Gailey, K. (1985). Química General. México: Nueva Editorial Interamericana.
Comments