Construcción de una curva de valoración redox
4 comments
¡Hola amigos!
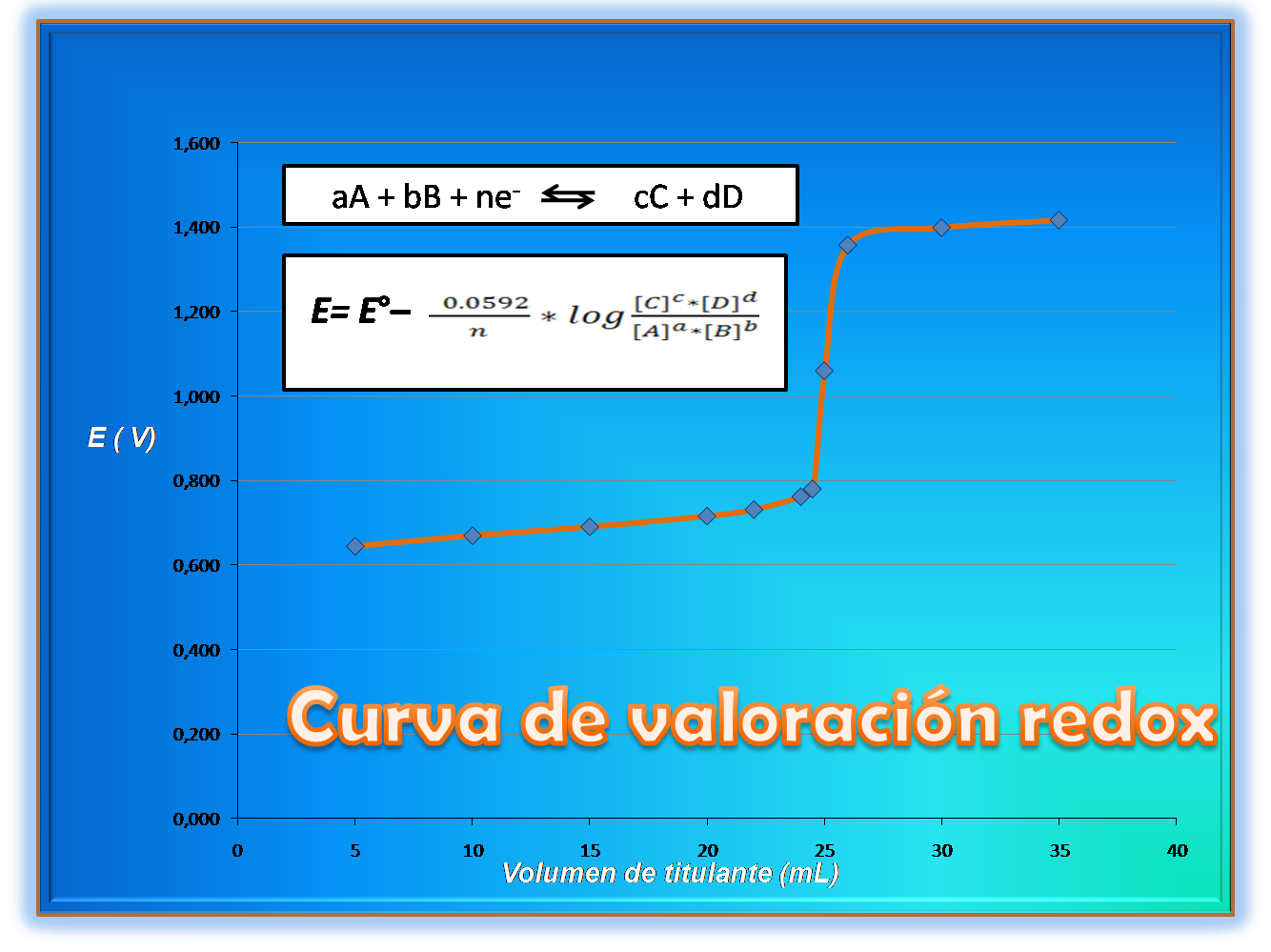
Una valoración redox puede ser evaluada a través de su curva, en este caso se mide el potencial electroquímico en función al volumen de titulante. Para la construcción de la curva teórica, se emplea la ecuación de Nernst que relaciona el potencial electroquímico con las concentraciones de los reactivos y productos en una determinada reacción. Les invito a revisar los cálculos involucrados para la obtención de los datos y de esta forma obtener la gráfica.
Fuente: @yusvelasquez
Analicemos una valoración en donde se valora un analito en su estado reducido Ared con una solución patrón en su estado oxidado Tox.
La reacción de valoración es:

El potencial de la reacción viene dado por la diferencia entre los potenciales de reducción de las semireacciones de reducción y oxidación. Estas reacciones son reversibles, por lo que durante la valoración al adicionar el titulante el sistema permanece en equilibrio, los potenciales de las dos semireacciones son iguales y el potencial electroquímico de la reacción es cero, es por ello que se puede emplear el potencial de cada semireacciones para medir el progreso de la valoración.
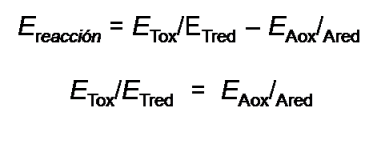
Estudiemos como se puede calcular el potencial a lo largo de la curva
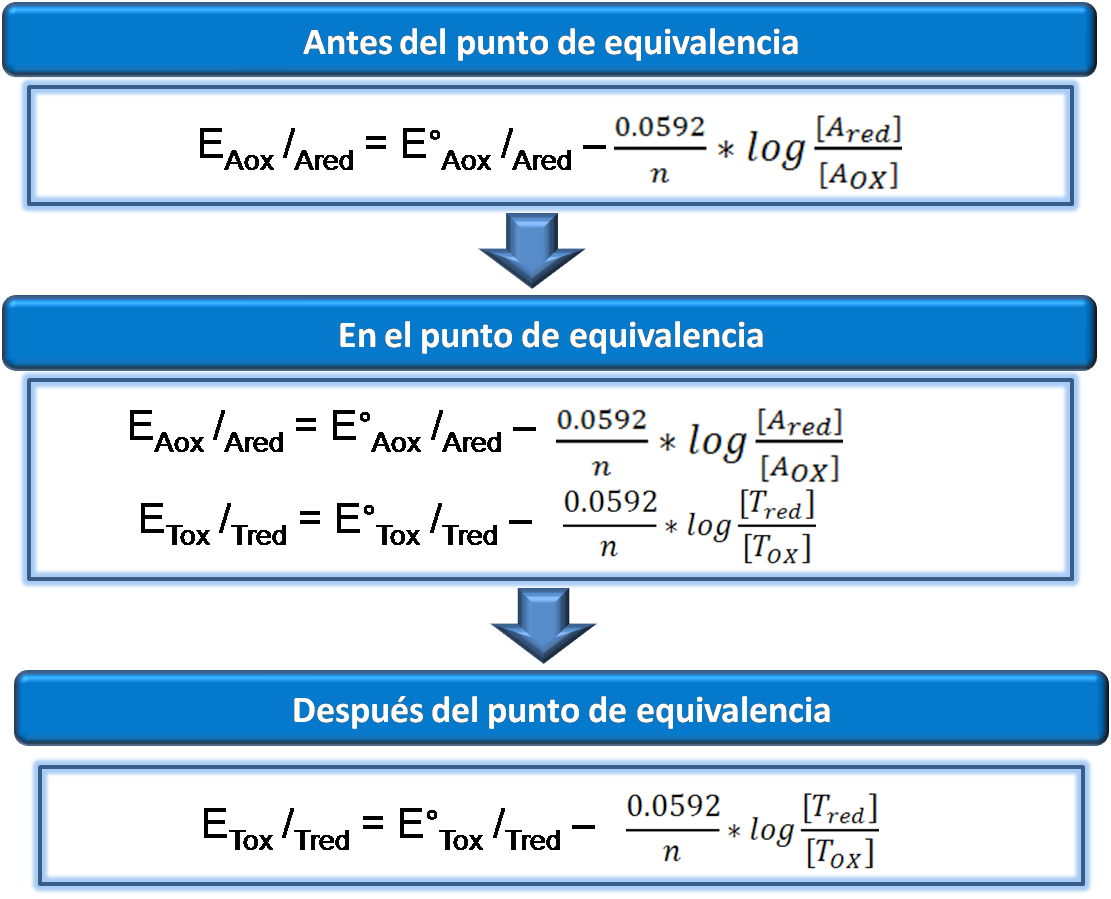
Potencial antes del punto de equivalencia: en esta zona predomina la forma oxidada y reducida del analito por lo que se emplea la ecuación de Nernst para la semireacción correspondiente. Las reacciones que se emplean en este tipo de valoraciones son lo suficientemente completas para que la concentración del titulante sea insignificante en relación a las otras especies. Los potenciales en esta zona empleando otro volumen pueden calcularse de la misma forma.
Potencial en el punto de equivalencia: en este punto el potencial se puede calcular partiendo de las relaciones de concentración de los reactivos y productos relacionando la semireacción del analito y la semireacción del titulante.
Potencial después del punto de equivalencia: en esta zona predomina la forma oxidada y reducida del agente titulante por lo que se pueden calcular los potenciales empleando la ecuación de Nernst para la semireacción correspondiente del titulante. Los potenciales en esta zona empleando otro volumen pueden calcularse de la misma forma.
En forma resumida se pueden emplear las siguientes ecuaciones para el cálculo del potencial a lo largo de la curva
Fuente: @yusvelasquez
Aplicación cuantitativa
Empleando la información mostrada anteriormente calculemos los potenciales para la construcción de la curva de valoración de 25mL de Fe+2 0.25M con Ce+4 0.25M. Hay que tomar en cuenta que el valor de la constante de equilibrio para esta reacción es muy grande por lo que se considera que la reacción entre el analito y la solución patrón es completa.
Los potenciales estándar de reducción según la bibliografía en este caso son los siguientes:
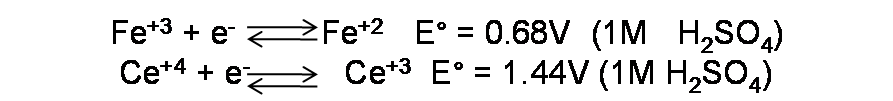
La reacción de valoración es:
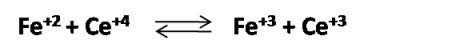
Para comenzar a calcular los potenciales es necesario calcular el volumen de Ce+4 que se debe adicionar para alcanzar el punto de equivalencia considerando la estequiometría de la reacción.
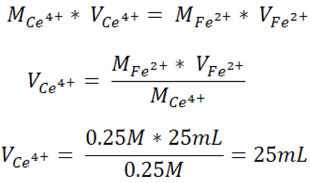
Este cálculo nos indica que los volúmenes que se pueden emplear en las distintas zonas son los siguientes:
- Potencial antes del punto de equivalencia 0mL<V<25mL
- Potencial en el punto de equivalencia V=25mL
- Potencial después del punto de equivalencia V>25mL
Potencial antes del punto de equivalencia
Calculemos por ejemplo el potencial antes del punto de equivalencia al añadir 5mL de Ce+4.
La ecuación de Nernst para la semireacción del analito viene dada por:
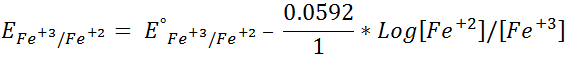
Las concentraciones se calculan de la siguiente forma:

Potencial en el punto de equivalencia
Seguimos con el cálculo del potencial en el punto de equivalencia. En este punto se combina la de Nernst para ambas semireacciones:
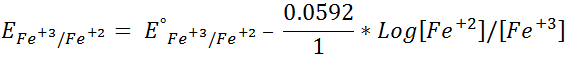
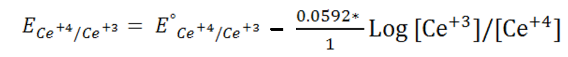
Se suman ambas semireacciones
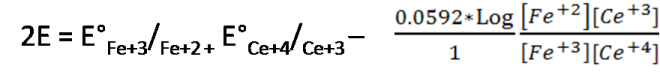
Aquí se cumple en base a la estequiometría de la reacción de valoración lo siguiente:
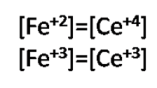
Por lo que la ecuación se reduce a
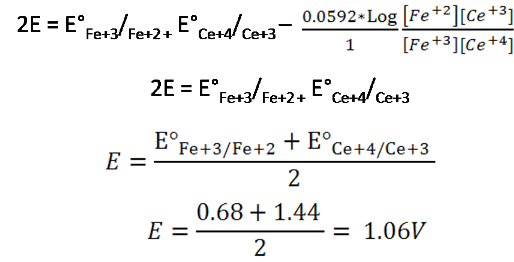
Potencial después del punto de equivalencia
Finalmente calculemos el potencial después del punto de equivalencia asumiendo un volumen de 30mL. La ecuación de Nernst para la semireacción del titulante viene dada por:
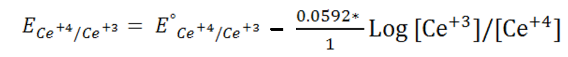
Las concentraciones se calculan de la siguiente forma:
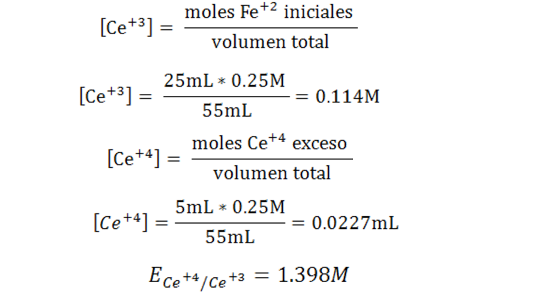
Construcción de la curva de valoración redox
Como se observa en la ecuación de Nernst existe una relación logarítmica entre el potencial de electrodo y la concentración del analito o titulante por lo que su forma se asemeja a una curva ácido/ base del tipo sigmoidal, en donde se grafica en el eje de las ordenadas el potencial vs el volumen de titulante. Para la obtención de una gráfica más exacta se puede calcular el potencial empleando otros volúmenes con la herramienta Excel y las ecuaciones descritas anteriormente.
En este caso la gráfica resultante es la siguiente, empleando los volúmenes que se presentan en la tabla con las respectivas concentraciones:
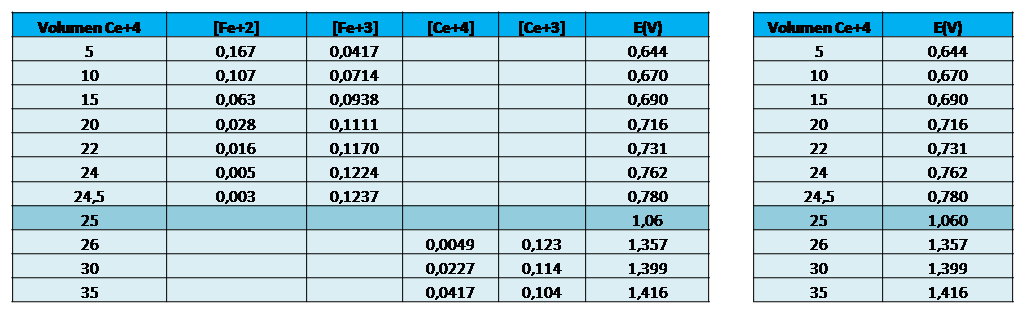
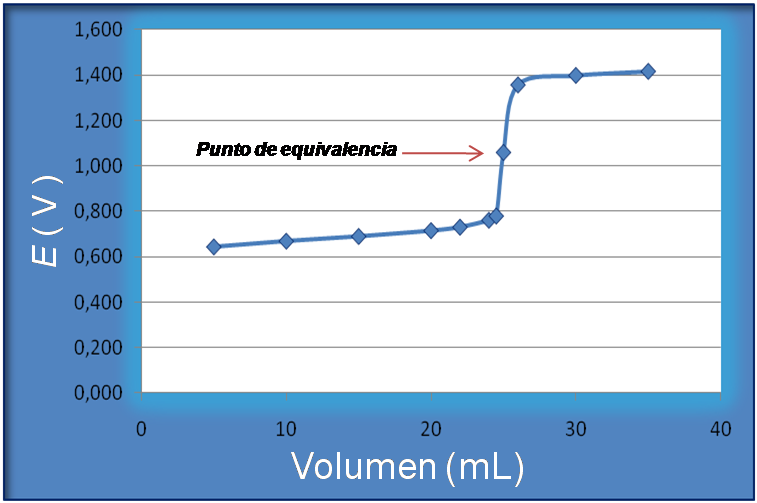
Fuente: @yusvelasquez
Las curvas de valoración pueden construirse a partir de datos obtenidos experimentalmente en el laboratorio, sin embargo, resulta importante conocer los fundamentos teóricos para el cálculo del potencial de forma que se puedan identificar las especies predominantes en cada zona, sus concentraciones, comparar los resultados y analizar las desviaciones.
¡Hasta aquí el presente post, espero les sea útil la información presentada, gracias por leer!
Referencias
- Skoog, W. (2000). Química Analítica. Mc Graw Hill
- Harvey, D.(2002). Química Analítica moderna. Mc Graw Hill.
Comments