Construcción de una curva de valoración ácido débil/base fuerte
6 comments
¡Hola estimados amigos de la comunidad científica de Hive!
Fuente:@yusvelasquez
El ácido fórmico es el ácido que inyectan algunas hormigas y abejas al picar, también constituye un componente natural de la miel. Es un líquido incoloro, soluble en agua, se ioniza fácilmente, y por medio de una valoración se puede determinar cuantitativamente su concentración.
Análisis de la curva de valoración de un ácido débil con base fuerte
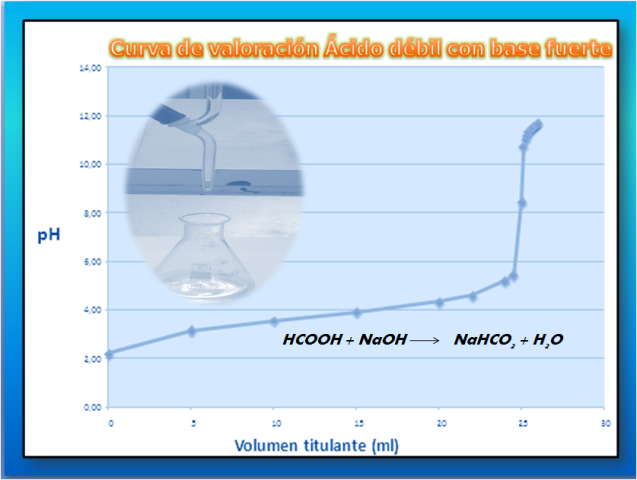
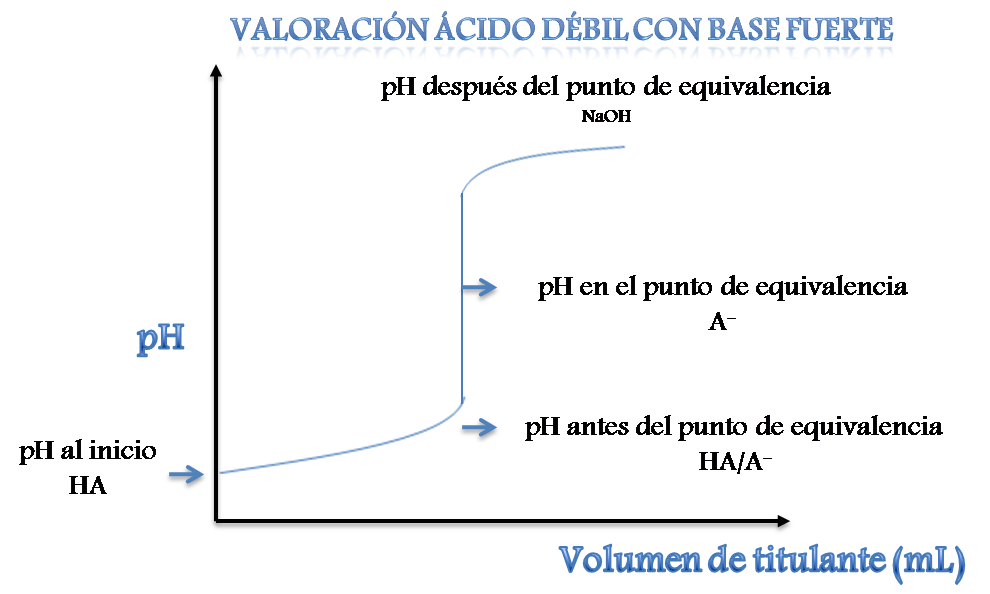
Cuando se valora una solución de ácido débil se obtiene una curva sigmoidal como se muestra a continuación
Fuente:@yusvelasquez
Si analizamos la curva observaremos algunos aspectos importantes en comparación con una curva de un ácido fuerte con base fuerte. Al comienzo de la valoración, se parte de un pH bajo y se puede calcular partiendo de la concentración del ácido débil (HA).
Antes del punto de equivalencia se forma una solución amortiguadora o buffer (HA/A-), se produce un cambio de pH cercano al punto de equivalencia sin embargo no es tan brusco, este tipo de ácidos generalmente no se titulan con bases débiles ya que el punto de equivalencia es difícil de localizar.
En este tipo de curvas el pH en el punto de equivalencia es distinto a 7, la reacción se completa y los moles del ácido son iguales a los moles de la base. En este punto el pH depende de la sal que se forme como producto de la reacción de neutralización (A-).
Más allá de este punto, el pH dependerá de la concentración en exceso de la base añadida.
Cálculos involucrados en la construcción de una curva de valoración de ácido débil con base fuerte
Para la construcción de una curva de valoración teórica se calcula el pH en cuatro zonas, ellas corresponden al inicio de la titulación, al adicionar un determinado volumen de titulante o antes del punto de equivalencia, en el punto de equivalencia y después del punto de equivalencia. Mientras más pH se calculen antes y después del punto de equivalencia más definida será la curva.
En este caso se presentan los cálculos en una valoración de 50 mL de HCOOH 0.2 M con NaOH 0.4M
Comencemos por escribir la reacción de titulación y calcular el volumen requerido para alcanzar el punto de equivalencia.
- Reacción de titulación
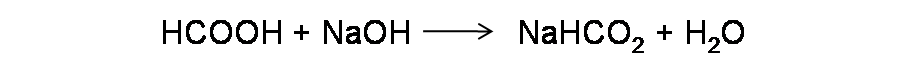
- Cálculo del volumen requerido en el punto de equivalencia
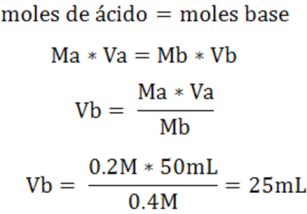
Este cálculo nos indica que para alcanzar el punto de equivalencia se requiere adicionar 25mL de NaOH. En el caso del cálculo de pH antes del punto de equivalencia se puede seleccionar un volumen mayor a 0 mL y menor a 25mL, en el caso del cálculo del pH después del punto de equivalencia se puede trabajar con un volumen mayor a 25mL.
Cálculo del pH al inicio de la titulación
En este punto el volumen de titulante añadido es 0 mL, por lo que el pH depende del ácido débil que se titula, para el cálculo se empleará un cuadro de equilibrio de la siguiente manera
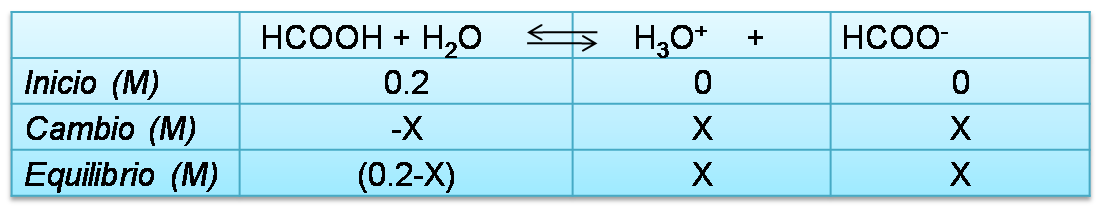
Los cálculos se basarán en la expresión de la constante (Ka) y su valor obtenido en la bibliografía.
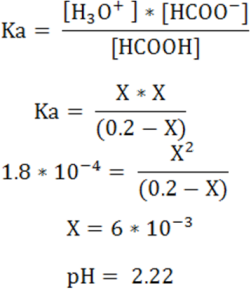
Cálculo del pH antes del punto de equivalencia
En esta zona el cálculo se realizará al añadir 5mL de NaOH, en caso de seleccionar otro volumen se puede seguir el mismo procedimiento, tomando en cuenta que la especie predominante es esta zona es el buffer que se forma.
Cálculo de moles iniciales

Se completa el cuadro de equilibrio con los moles calculados anteriormente
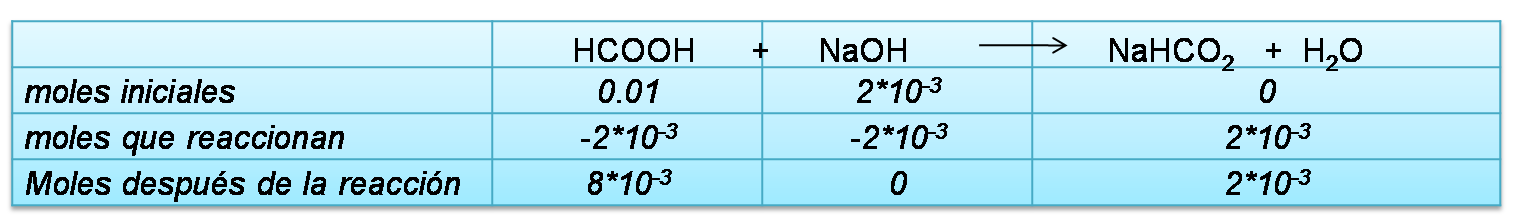
Cálculo de las concentraciones en el equilibrio

Cálculo del pH
En este caso se se hace uso de la ecuación de Henderson-Hasselbalch para el cálculo de pH de la solución buffer.
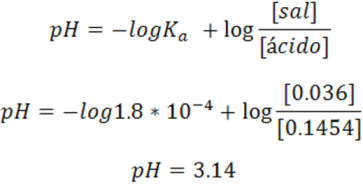
Cálculo del pH en el punto de equivalencia
En este punto la reacción es completa y se debe añadir un volumen de 25mL de NaOH. Los cálculos se pueden realizar de forma similar a la zona anterior tomando en cuenta que en este caso la especie predominante es la sal formada.
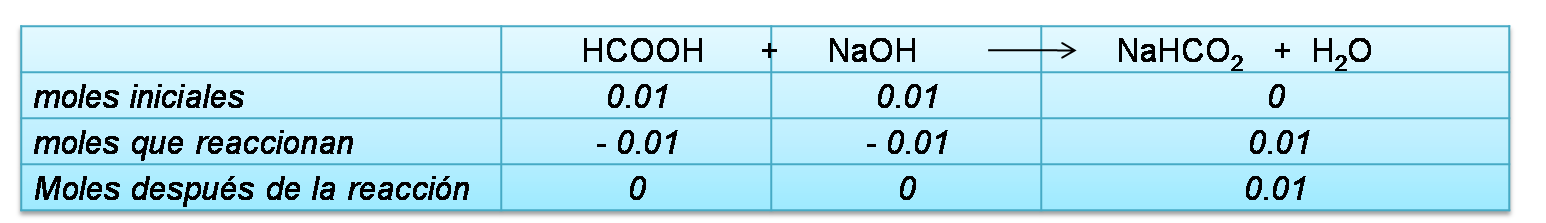
Cálculo de la concentración de la sal formada
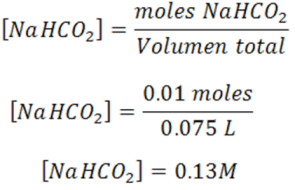
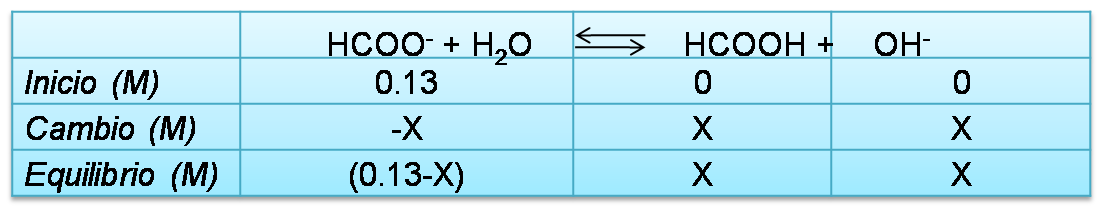
Reacción de hidrólisis
En este caso el anión HCOO- se hidroliza por lo que se emplea el valor de Kb
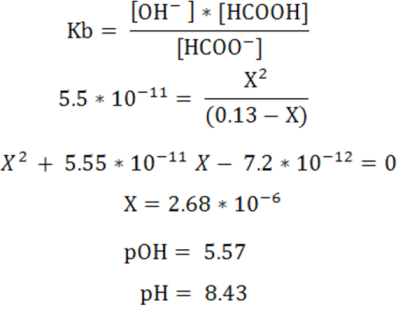
Como se observa en este punto se obtiene un pH básico > 7, ya que la sal formada proviene de un ácido débil y una base fuerte predominando la hidrólisis del anión.
Cálculo del pH después del punto de equivalencia
En esta zona se puede trabajar con un volumen mayor a 25mL, en este caso se trabajó con 26mL. El pH depende del exceso de NaOH adicionado y se puede calcular de la siguiente forma
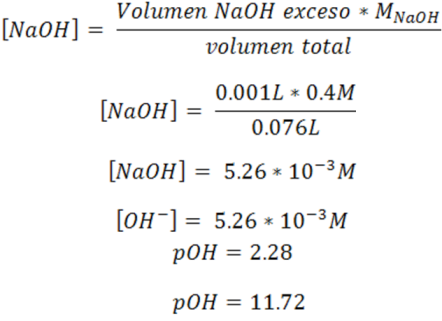
A continuación se presenta la curva de valoración obtenida empleando otros volúmenes de titulante mediante la elaboración de una hoja en excel lo que permite realizar el cálculo para distintas especies y concentraciones así como también elaborar la gráfica.
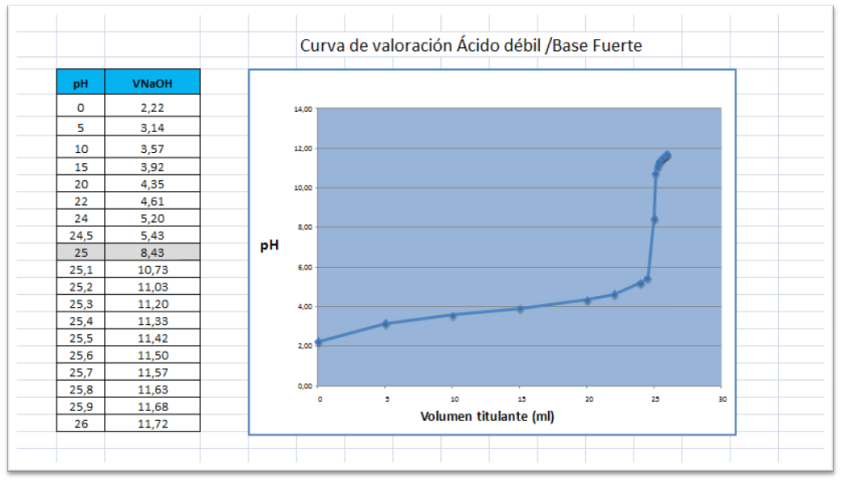
Fuente:@yusvelasquez
Hay que destacar que la curva de valoración de una base débil con ácido fuerte se puede obtener de forma similar a la información presentada, tomando en cuenta que la diferencia se encuentra en que al inicio el pH es alto, la solución es básica. En el punto de equivalencia la sal formada es ácida, se hidroliza el catión y al sobrepasar este punto el pH depende del exceso de ácido añadido.
Conocer y dominar los cálculos involucrados para construir la curva de valoración teórica cuando se lleva a cabo una determinada reacción resulta importante ya que dependerán de las especies que predominan en cada zona por lo que el tratamiento es distinto,por otra parte el calcular el pH en el punto de equivalencia permitirá seleccionar el indicador adecuado para detectar el punto final em la valoración, adicionalmente graficando la curva se puede realizar una comparación entre la curva experimental y la curva teórica analizando las desviaciones.
¡Hasta aquí el presente post amigos, espero que la información les sea de mucha utilidad, gracias por leer!
Referencias
- Skoog, W.(2000) Química Analítica. Mc Graw Hill
- Hamilton, S. Cálculos de Química Analítica. Mc Graw Hill. Séptima edición
- Harvey, D.(2002). Química Analítica moderna. Mc Graw Hill.
Comments